1. (2025·南充改编)几种固体的溶解度曲线如图所示,下列说法正确的是 (
C
)
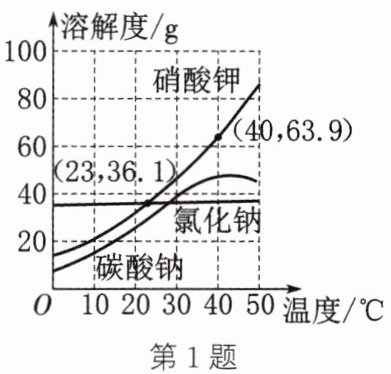
A.$23^{\circ}C$时,硝酸钾和氯化钠溶液中溶质的质量分数相等
B.升高温度,固体的溶解度都增大
C.盐湖工场“冬天捞碱$(Na_{2}CO_{3})$”是利用降温结晶的原理
D.$40^{\circ}C$时,将$40g$硝酸钾加入$50g$水中,充分溶解后所得溶液为不饱和溶液
答案:1.C 解析:由于没有指明溶液是否饱和,所以23°C时,硝酸钾和氯化钠溶液中溶质的质量分数不一定相等,A错误。由碳酸钠的溶解度曲线可知,升高温度,固体的溶解度不一定都增大,B错误。碳酸钠的溶解度受温度变化的影响较大,冬天气温低,碳酸钠易结晶析出,盐湖工场“冬天捞碱(Na₂CO₃)”是利用降温结晶的原理,C正确。40°C时,硝酸钾的溶解度为63.9g,40°C时,将40g硝酸钾加入50g水中,最多只能溶解31.95g硝酸钾,则充分溶解后所得溶液为饱和溶液,D错误。
2. (2025·无锡模拟)“果蔬洗盐”是一种果蔬清洁剂,某“果蔬洗盐”的部分标签如图甲所示,配料中物质的溶解度曲线如图乙所示。下列说法正确的是 (
B
)
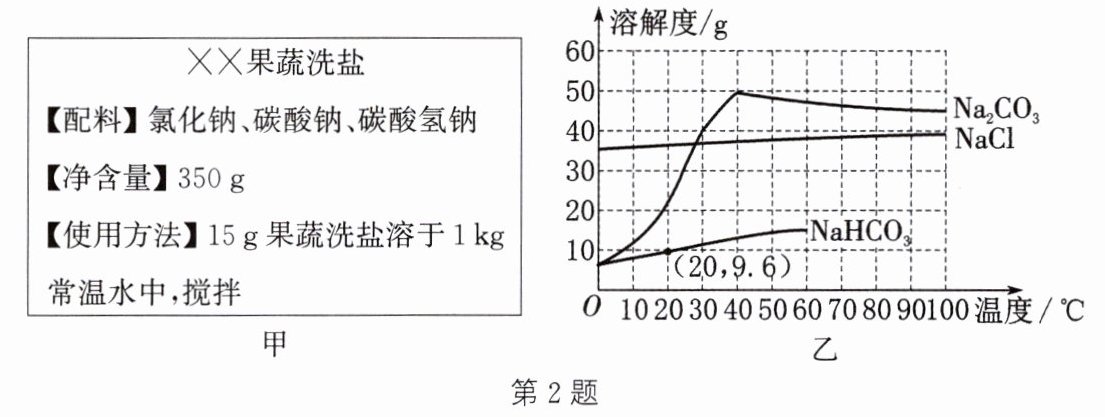
A.$Na_{2}CO_{3}$的溶解度比$NaCl$小
B.饱和的$Na_{2}CO_{3}$溶液从$40^{\circ}C$降温到$20^{\circ}C$,有晶体析出
C.$20^{\circ}C$时,取$15g$“果蔬洗盐”溶于$1kg$水中,形成的溶液是$NaCl$的饱和溶液
D.$20^{\circ}C$时,$NaHCO_{3}$饱和溶液的溶质质量分数为$9.6\%$
答案:2.B 解析:比较溶解度大小时必须指明温度,A错误;由溶解度曲线可知,将饱和的Na₂CO₃溶液从40°C降温到20°C,Na₂CO₃的溶解度变小,有晶体析出,B正确;由溶解度曲线可知,20°C时,氯化钠的溶解度大于30g,即在该温度下,100g水中能溶解30g以上的氯化钠,1000g水中能溶解300g以上的氯化钠,所以20°C时,取15g“果蔬洗盐”溶于1kg水中,形成的溶液是NaCl的不饱和溶液,C错误;20°C时,NaHCO₃的溶解度为9.6g,故其饱和溶液的溶质质量分数为$\frac{9.6g}{100g+9.6g}×100%≈8.8%,$D错误。
3. (2024·渭南韩城模拟)$20^{\circ}C$和$60^{\circ}C$时$KCl$的溶解度分别为$34.0g$和$45.5g$,如图所示为用$KCl$进行的溶解实验。下列分析正确的是 (
B
)
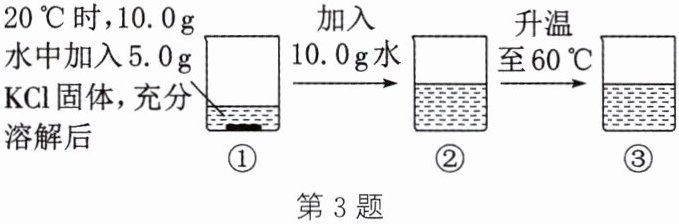
A.①中溶液为$KCl$的饱和溶液,不能再溶解其他任何固体
B.②中溶液的质量为$25.0g$
C.溶液中溶质的质量:①$<$②$<$③
D.溶液的溶质质量分数:①$>$②$>$③
答案:3.B 解析:20°C时KCl的溶解度为34.0g,则20°C时10g水中最多能溶解3.4gKCl,因此20°C时,向10.0g水中加入5.0gKCl固体,KCl固体不能全部溶解,有剩余,故①中溶液为KCl的饱和溶液,但KCl的饱和溶液还可以溶解其他溶质,如KNO₃等,A错误。20°C时KCl的溶解度为34.0g,20°C时20g水中最多能溶解6.8gKCl,则烧杯②中5.0gKCl能全部溶解,②中溶液的质量为5.0g+20.0g=25.0g,B正确。由图示可知,②→③的过程中溶质质量不变,故溶液中溶质的质量:①<②=③,C错误。①是20°C时KCl的饱和溶液,②是20°C时KCl的不饱和溶液,则溶质质量分数:①>②;②③中溶质和溶剂的质量均相等,两种溶液的溶质质量分数也相等,则溶液的溶质质量分数:①>②=③,D错误。
4. (2025·重庆期中)如表是$KNO_{3}$和$NH_{4}Cl$在不同温度时的溶解度。
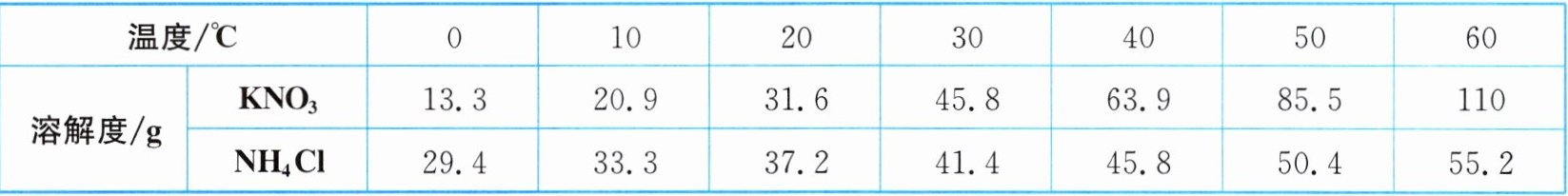
(1) 根据数据,绘制二者的溶解度曲线如图所示,$a$点为曲线的交点。下列说法错误的是
C
(填字母)。
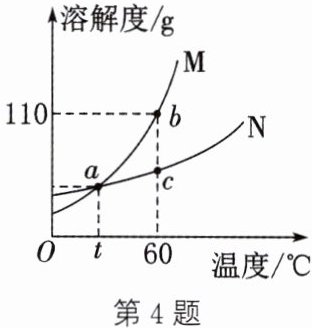
A. 二者的溶解度均随温度升高而增大
B. $M$为$KNO_{3}$
C. $a$点对应的温度在$30^{\circ}C$与$40^{\circ}C$之间
D. $a$点对应的溶解度在$37.2g$与$41.4g$之间
(2) $60^{\circ}C$时,$c$点的$KNO_{3}$溶液属于
不饱和
(填“饱和”或“不饱和”)溶液。欲将处于$c$点的$KNO_{3}$溶液转变为$b$点,可以采取
增加溶质
(填“降低温度”或“增加溶质”)的措施。
(3) 若不改变溶剂的质量,将$60^{\circ}C$时的$155.2gNH_{4}Cl$的饱和溶液降温至$10^{\circ}C$,能析出$NH_{4}Cl$晶体的质量为
21.9
g。
(4) 将$t^{\circ}C$时$M$、$N$的饱和溶液均升温到$60^{\circ}C$,所得溶液的溶质质量分数的大小关系是$M$
=
(填“$>$”“$<$”或“$=$”)N。
答案:4.(1)C (2)不饱和 增加溶质 (3)21.9 (4)=
解析:(1)分析题表中数据可知,二者的溶解度均随温度升高而增大,A正确;硝酸钾的溶解度受温度变化影响较大,所以M为KNO₃,B正确;a点时两物质的溶解度相等,题表中20°C时硝酸钾的溶解度小于氯化铵,30°C时硝酸钾的溶解度大于氯化铵,故a点对应的温度在20°C与30°C之间,a点对应的溶解度在37.2g与41.4g之间,C错误、D正确。(2)60°C时,c点是硝酸钾溶解度曲线的线下点,所以c点的硝酸钾溶液属于不饱和溶液;欲将处于c点的KNO₃溶液转变为b点,可以采取增加溶质的措施。(3)60°C时,氯化铵的溶解度为55.2g,155.2g氯化铵的饱和溶液是由100g水和55.2g氯化铵组成的,降温至10°C,100g水中最多溶解33.3g氯化铵,故析出NH₄Cl晶体的质量为55.2g-33.3g=21.9g。(4)t°C时,M、N的溶解度相等,饱和溶液的溶质质量分数也相等,M、N的溶解度都随温度升高而增大,升温到60°C,M、N的饱和溶液均变为不饱和溶液,但是溶质的质量和溶剂的质量均未变化,所以两溶液的溶质质量分数的大小关系是M=N。