7. (2024·安徽)我国化学家侯德榜发明的侯氏制碱法,开创了世界制碱工业的新纪元。制碱工艺中的关键反应为NaCl + CO₂ + NH₃ + H₂O = NaHCO₃↓ + NH₄Cl。室温(20℃)下,某兴趣小组在实验室利用如图装置模拟该反应。
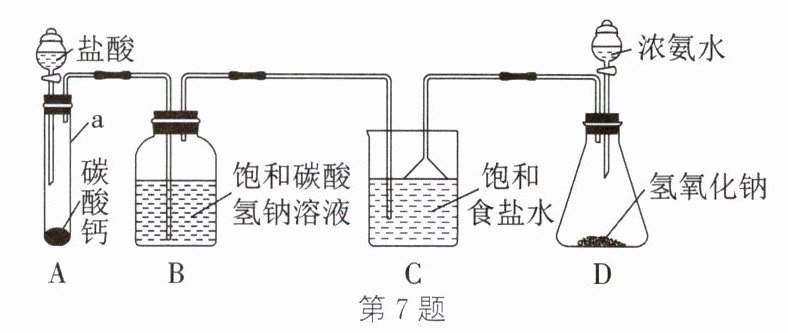
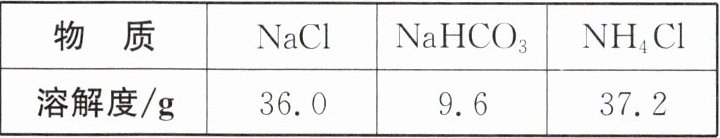
已知:① 20℃时,几种盐的溶解度如表。② 氨气极易溶于饱和食盐水,形成的溶液呈碱性。
(1) 为配制饱和食盐水,应向100g水中至少加入
36.0
g NaCl固体。
(2) 仪器a的名称是
试管
,装置D的作用是
产生氨气,防止倒吸
。
(3) 装置A制取的CO₂中会混有HCl,用饱和NaHCO₃溶液吸收HCl的化学方程式为
$\mathrm{NaHCO}_{3}+\mathrm{HCl}=\mathrm{NaCl}+\mathrm{H}_{2}\mathrm{O}+\mathrm{CO}_{2}\uparrow$
。
(4) 为使CO₂在装置C中能被充分吸收,可采取的措施是
先打开装置D分液漏斗活塞,再打开装置A分液漏斗活塞
。充分反应后,装置C中有晶体析出。为分析晶体产生的原因,兴趣小组继续开展探究。
查阅资料:一定条件下,可溶性物质的溶解存在限度,当相应离子浓度过大时,可溶性物质会部分结晶析出。
(5) 装置C中析出的晶体主要成分是NaHCO₃而不是NH₄Cl,原因是
相同温度下,$\mathrm{NaHCO}_{3}$的溶解度比$\mathrm{NH}_{4}\mathrm{Cl}$的小,在相同温度下在同样多的水中最多溶解的$\mathrm{NaHCO}_{3}$的质量远小于$\mathrm{NH}_{4}\mathrm{Cl}$,不能溶解的$\mathrm{NaHCO}_{3}$以晶体形式析出
。
(6) 装置C中的物质过滤后得到的滤液在工业上称为母液。侯氏制碱法通过向母液中加入食盐,使NH₄Cl结晶析出,析出晶体的原因是
增大$\mathrm{Cl}^{-}$浓度,生成的氯化铵更多,不能溶解的氯化铵结晶析出
。